目前新冠病毒(SARS-CoV-2)疫情仍处于流行阶段,最近在法国出现的Omicron亚变体BA.2.86的子代变异株—JN.1迅速向全球蔓延。因此,对BA.2.86亚变体病毒学特征的揭示和有效抗病毒药物的研发,对于该病毒及其子代的防控具有重要意义。近期,复旦大学基础医学院医学分子病毒学教育部/卫健委/医科院重点实验室、上海市重大传染病和生物安全研究院双聘PI陆路/姜世勃/夏帅团队通过对BA.2.86膜融合动力学的分析,揭示了该病毒的膜融合特征。同时,该团队将其在前期开发出来的通用冠状病毒融合抑制剂多肽EK1(现在II/III临床试验中)通过原核表达技术进行制备,所产生的多肽—reEK1具有广谱、高效的抗病毒活性,还具有可大规模生产且成本较低的潜在优势,对当前新冠病毒或未来可能爆发的其他冠状病毒引发的大流行传染病防控提供了药物研发新思路。该研究成果在今年1月9日发表在国际知名期刊Cell Discovery(中科院I区期刊, IF=33.5)。

SARS-CoV-2依赖包膜表面刺突(S)蛋白介导感染,S蛋白介导的病毒与细胞膜发生的膜融合过程是SARS-CoV-2入侵靶细胞的重要途经。其与病毒的感染能力和致病性密切联系。变异株S蛋白中出现的不同突变将影响SARS-CoV-2的膜融合特征,也使得变异株可能具有药物抵抗及免疫逃逸的能力。最近出现的新冠病毒变异株BA.2.86仅在S蛋白上就累积了共33个不同突变,且与目前主流Omicron变异株差异较大,并在一些非结构蛋白(如NSP2、NSP3)上也出现新突变位点(图1)。
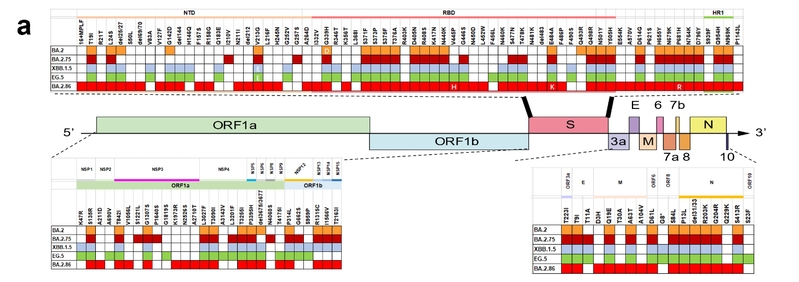
图1
研究者通过建立带有GFP荧光的膜融合系统,评估了变异株BA.2.86的融合动力学特征,并发现其S2亚单位中S939F突变位点对膜融合能力具有较大贡献。结果显示,在人来源肺部细胞Calu-3为代表的多种靶细胞中,BA.2.86的融合效率比其前代变异株BA.2明显升高。因此,具有独特突变模式的BA.2.86已经开启新冠病毒全新的进化方向,未来其可能进化出具有更强膜融合能力和传播能力及免疫逃逸能力的子代变异株,但目前针对该类变异株的融合抑制剂尚未有相关报道。
姜世勃/陆路团队在既往研究中发现,包含SARS-CoV-2在内的冠状病毒HR1结构域极其保守,阐明了靶向冠状病毒HR1是研发广谱抗冠状病毒多肽类抑制剂的关键机制(Lancet 2004; Nat commun 2014; Cell Res 2020),并依此成功开发了一系列广谱抗病毒多肽,如EK1、EK1C4等( Scie Adv 2019; STTT 2021; Cell Res 2022)。而在本研究中,该团队利用原核表达系统,研发出了广谱抗冠状病毒多肽reEK1及其重组原核表达工艺,为大规模抗冠状病毒药物储备提供了新方案。
EK1是一种广谱、高效的多肽类冠状病毒融合抑制剂,目前正在II/III期临床试验中。由于多肽药物的化学合成成本较高,限制了其在大规模疫情防控时代的应用,而本研究提供了一种经原核表达系统大量生产多肽药物的新方案。原核表达的reEK1多肽与化学合成EK1多肽序列完全一致,纯度高(多肽纯度>99%),并且兼具产量大、成本低的潜在优势。
结果表明,reEK1可以高效抑制BA.2.86的S蛋白介导的细胞-细胞融合过程(IC50 = 331 nM),并在假病毒感染系统上也显示出良好的抑制活性(IC50 = 298 nM)(图2)。同样,在其它新冠病毒变异株S蛋白介导的细胞-细胞融合模型上,其IC50 均在在243 ~ 420 nM范围内,因而进一步表明其具有很好的广谱性,可以应对目前和未来新冠变异株或其它新发与再现的冠状病毒感染。
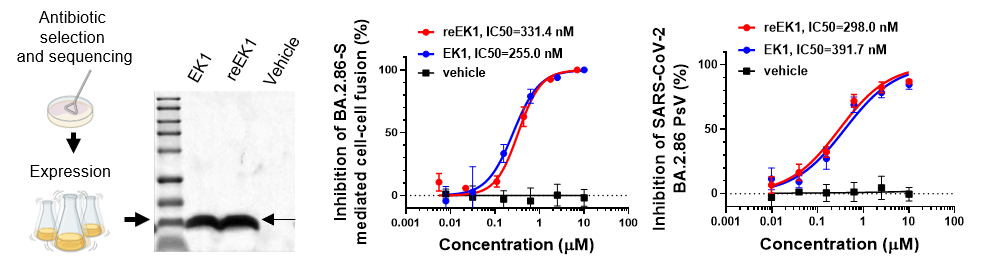
图2
为了进一步探索reEK1在体内的抗病毒效果,研究者对hACE2转基因小鼠模型进行鼻腔雾化给药,试验结果表明reEK1可有效地预防SARS-CoV-2(BA.2)活病毒对小鼠的感染,显著降低小鼠肺部的病毒载量,从而改善肺部病理损伤,展现出良好的抗病毒临床应用前景(图3)。
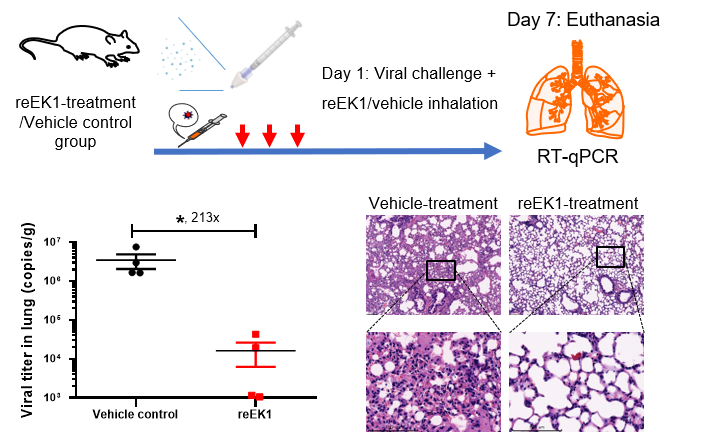
图3
原核表达多肽工艺能够促进高产量、低成本的多肽药物的生产,或许能够替代传统化学合成工艺,为未来大规模的冠状病毒疫情防控提供抗病毒药物的储备。
复旦大学博士研究生王李珏为第一作者,上海市重大传染病和生物安全研究院陆路研究员、姜世勃教授、夏帅青年研究员以及中科院生物物理研究所朱赟研究员为该论文的共同通讯作者。
原文链接:https://doi.org/10.1038/s41421-023-00631-2

