蛋白质的泛素化修饰与真核生物的细胞生命过程息息相关。Cullin-RING E3泛素连接酶(Cullin-RING E3 ligases, CRLs)作为人体泛素-蛋白酶体系统(Ubiquitin-Proteasome System, UPS)的重要元素,是哺乳细胞中最大的E3泛素连接酶家族,调控底物的特异性识别、泛素化修饰及降解,是机体行使正常功能的关键调节因子。其中的CRL3特异性的使用BTB蛋白作为底物调控蛋白。人体内有180多种BTB蛋白,CRL3复合物在糖脂代谢、癌症发生、细胞周期、发育等生理过程中都发挥重要作用。然而,CRL3结构复杂,目前对其结构及催化作用机制了解甚少。

2024年2月8号,上海市重大传染病和生物安全研究院兼聘PI、复旦大学孙蕾研究员、美国德克萨斯大学西南医学中心Bruce Beutler院士、复旦大学陈振国研究员团队合作,在Nature Structural & Molecular Biology上发表题为Dynamic molecular architecture and substrate recruitment of cullin3–RING E3 ligase CRL3KBTBD2的研究论文,该研究以KBTBD2特异性招募p85α蛋白为切入点,系统研究了CRL3KBTBD2调控底物p85α蛋白过程中的结构变化和功能特征。
p85α是3-磷酸肌醇-α(Phosphoinositide 3-kinase, PI3Kα)的调节亚基,与p110α催化亚基组装成PI3Kα异源二聚体,通过PI3K信号通路调节胰岛素的信号传导。KBTBD2是近年来新发现的p85α调控蛋白,在Kbtbd2缺陷型小鼠中,p85α过量积累造成胰岛素代谢异常,导致小鼠出现发育迟缓、体型过小、脂肪变性、胰岛素抵抗和Ⅱ型-糖尿病,甚至死亡等症状。KBTBD2与CUL3-RBX1组装成E3连接酶复合体(CRL3KBTBD2),催化底物p85α的泛素化修饰及降解,影响胰岛素代谢,并可能导致糖尿病。
研究揭示了CRL3 KBTBD2在其催化循环过程中多个状态下的动态组装和分子机制,包括CRL3KBTBD2自组装,底物招募(CRL3KBTBD2-p85α)、活化(CRL3KBTBD2~NEDD8)、去活化(CRL3KBTBD2~NEDD8-CSN)、底物受体交换(CUL3-RBX1-CAND1)等七种状态下的冷冻电镜结构及相应的功能活性,是目前最为完善的CRL3结构及催化机制研究工作(图1)。
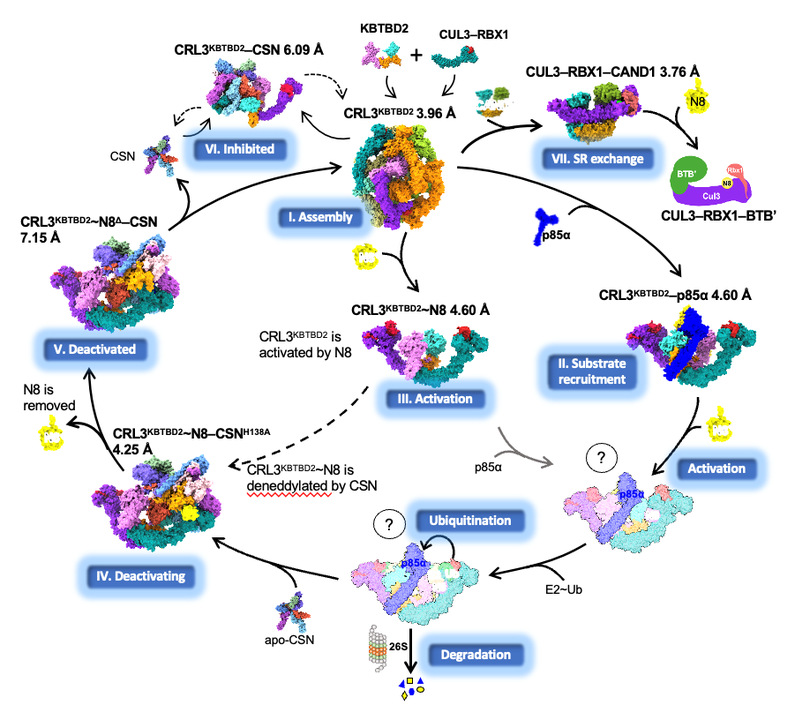
图1. CRL3KBTBD2的催化循环
与CRL家族中大多数单体结构不同,KBTBD2蛋白的二聚体特性使得CRL3KBTBD2在分子组装方面更加复杂。单独的CRL3KBTBD2自组装成独特的四/六/八聚体结构,其酶活中心不完全暴露,当与p85α、NEDD8或CSN等分子结合后会逐步解聚为二聚体,酶活中心及底物结合位点完全暴露。
确定不同CRLs E3泛素连接酶的底物并充分了解它们的底物识别与招募机制一直是个巨大挑战,理解底物招募过程需要建立在系统全面的CRLs-底物复合体结构及功能的基础之上。CRL3KBTBD2招募全长底物p85α时,KBTBD2与p85α的结合涉及到两个蛋白的多个互作面。KBTBD2的BTB-BACK与Kelch两个结构域协同发挥作用,为底物的招募提供最大的结合力。该研究是目前为数不多的针对全长底物展开CRLs E3招募机制研究的工作,补充了CRLs招募全长底物的分子机制空白。
综合以上对CRL3KBTBD2 E3泛素复合体的动态组装以及对p85α的底物招募机制,文章首次提出CRL3KBTBD2多状态下的组装模式及其催化循环模型,阐述了CRL3KBTBD2通过在不同状态下的动态构象变化实现对底物的招募机制。
值得一提的是,同期Nature Structural & Molecular Biology杂志聚焦”泛素化”,发表了多篇泛素化系统的研究论文以及相关评论(Comment),展示了广大研究人员对泛素化机制及应用的持续关注。

复旦大学生物医学研究院博士生胡玉霞(已毕业)、美国德克萨斯大学西南医学中心张召教授、复旦大学生物医学研究院博士生毛绮妤、张翔、郝爱华为论文的共同第一作者。上海市重大传染病和生物安全研究院/复旦大学生物医学研究院孙蕾研究员、美国德克萨斯大学西南医学中心Bruce Beutler院士、复旦大学生物医学研究院陈振国研究员为论文的共同通讯作者。
原文链接:https://www.nature.com/articles/s41594-023-01182-6

