2024年4月9日,上海市重大传染病和生物安全研究院/复旦大学基础医学院的姜世勃/陆路/徐巍团队在mBio(中科院一区,IF:6.4)上在线发表了题为“Inhibition of influenza A virus and SARS-CoV-2 infection or co-infection by griffithsin and griffithsin-based bivalent entry inhibitor”的研究论文。
以流感病毒和冠状病毒为代表的呼吸道病毒曾多次引发急性呼吸道传染病大流行,导致数千万人死亡。甲型和乙型流感病毒常引起季节性流感,而甲型流感病毒(IAV)更易引发全球大流行。近年来,高致病性禽流感病毒A(H5N1)分支2.3.4.4b影响全球鸟类,成为最大规模的禽流感疫情,已有跨洲际和跨物种传播,未来可能感染人类并引发全球大流行。
由新冠病毒(SARS-CoV-2)引发的新冠(COVID-19)疫情严重威胁全球公共卫生、社会稳定和经济发展。目前,新冠病毒Omicron变异株及其亚变体成为主要流行株,比早期新冠病毒显示出更强的受体结合和免疫逃逸能力,增加突破性感染和再感染风险增加。已有研究显示, IAV和SARS-CoV-2的共感染会导致更严重的肺组织损伤和更严重的临床症状。因此,有必要开发能够治疗或预防IAV和SARS-CoV-2共感染的广谱抗病毒药物。
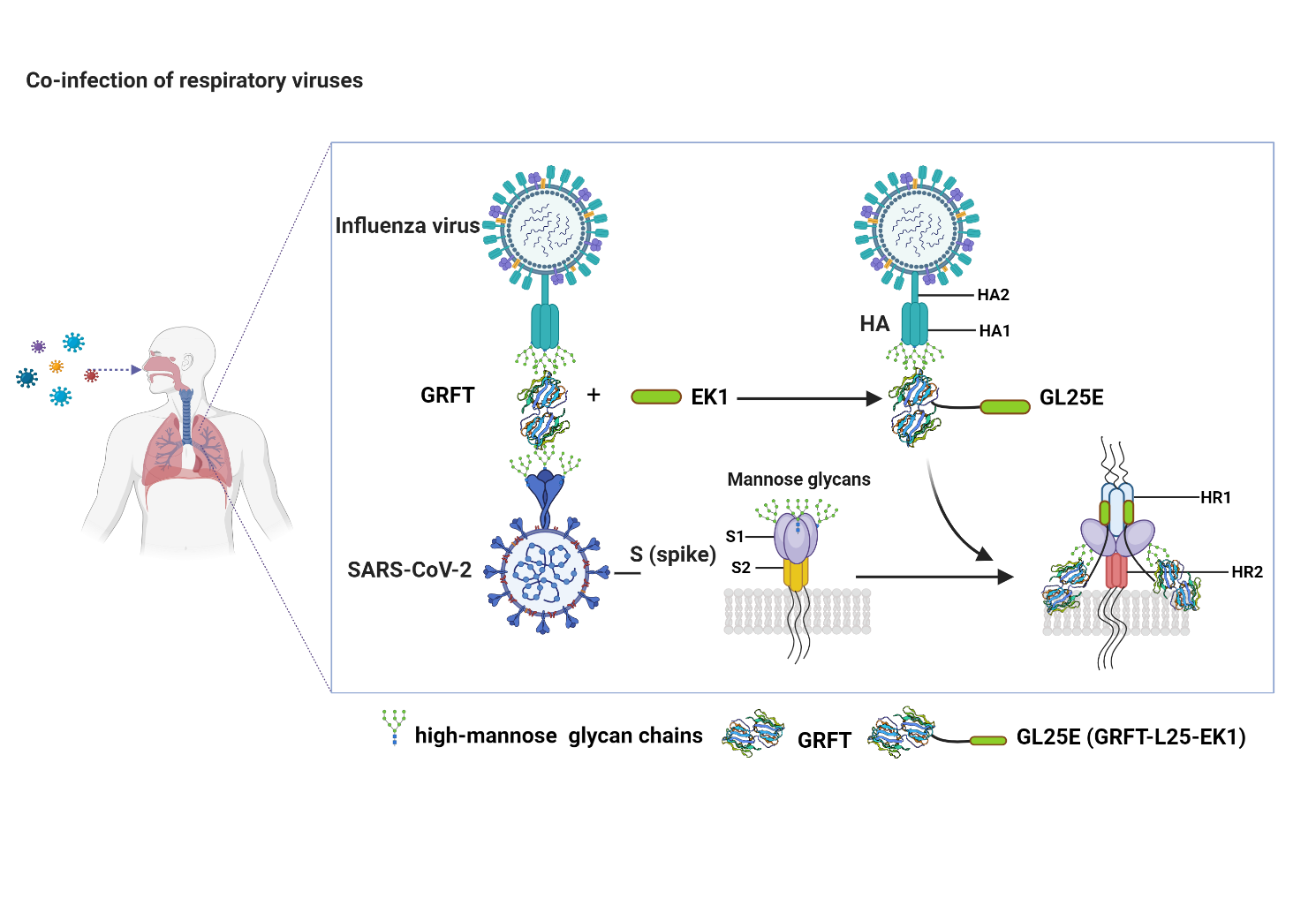
红藻凝集素G(griffithsin,简称GRFT)是从海洋红藻(Griffithsia sp.)中分离出来的一种藻类凝集素,可与病毒表面蛋白中的糖基结合而干扰其功能,从而阻断病毒入侵宿主细胞。现已报道GRFT可有效地抑制人免疫缺陷病毒(HIV)、严重急性呼吸综合征冠状病毒(SARS-CoV)、中东呼吸综合症冠状病毒(MERS-CoV)、日本脑炎病毒(JEV)、丙型肝炎病毒(HCV)、猪流行性腹泻病毒(PEDV)的感染。
病毒入侵宿主细胞是其感染的开始,而病毒表面的关键蛋白在病毒入侵中起关键作用。这些蛋白是开发抗病毒药物的重要靶标。SARS-CoV-2和IAV分别利用其表面的刺突(S)蛋白和血凝素(HA)蛋白来与宿主细胞上的特定受体结合。由于这些表面蛋白上有大量糖基化位点,推测GRFT和GL25E能通过与S和HA蛋白上的糖基结合,阻止SARS-CoV-2和IAV入侵宿主细胞。
姜世勃团队的前期研究证明GRFT可有效地抑制新冠病毒及其变异株的感染,作用机制研究显示GRFT能够结合S蛋白,特别是S1亚单位,而甘露糖能够抑制GRFT的抗SARS-CoV-2活性,提示其作用靶点是SARS-CoV-2-S蛋白表面的糖基化位点(Cai Y et al. Virol Sin.2020; 35, 857)。他们还发现GRFT与EK1多肽联用,具有协同抗新冠病毒效应,而重组蛋白GL25E(GRFT-L25-EK1)比单用GRFT更有效,提示GL25E可以通过其GRFT部分与S1蛋白上的糖基位点结合,并通过其EK1部分与S2蛋白中的HR1区域相互作用而达到双靶点作用效果(Cai Y et al. Cell Biosci.2021;11, 128)。
本研究证明GRFT和GL25E均能有效地抑制H7N9和H5N1流感假病毒以及H3N2和H1N1流感活病毒的感染,在小鼠体内也表现出较好的预防和治疗H1N1感染的有效果和安全性。作用机制研究证明GRET和GL25E都能够作用于流感病毒HA1蛋白上的糖基化位点来抑制IAV感染,而GL25可同时作用于新冠病毒S1亚基上的糖基化位点和S2亚基中HR1区,能更有效地抑制新冠病毒及其变异株的感染和新冠病毒与流感病毒的共感染。此外,GL25E显示出较好的稳定性、长效性和动物体内的安全性等成药性特征,有望被开发成为安全、有效的广谱抗病毒药物或医疗产品,防控未来新发与再现的冠状病毒和流感病毒的单感染或共感染。
复旦大学曹娜静和蔡艳星博士毕业生为共同第一作者,上海市重大传染病和生物安全研究院姜世勃教授、上海市重大传染病和生物安全研究院/复旦大学基础医学院陆路研究员和复旦大学基础医学院徐巍青年副研究员为本文的共同通信作者。
原文链接:https://doi.org/10.1128/mbio.00741-24


