在感染部位启动适度的宿主应答对清除病原体和避免过度炎症损伤非常重要。因此,深入了解组织特异表达因子对宿主应答的调控,有助于优化组织环境诱导更为安全有效的抗感染应答。耐药金黄色葡萄球菌(金葡菌)是医院和社区感染的主要病原菌,成为了亟待解决的严重公共卫生问题。皮肤是金葡菌感染最常见的部位,重者可以发生血源性扩散,引起危及生命的侵袭性感染。
Chemerin是一个脂肪因子,其功能性受体CMKLR1主要表达于巨噬细胞、上皮细胞和脂肪细胞。既往研究表明Chemerin/CMKLR1轴可以抑制病理性中性粒细胞炎症,减轻组织损伤。有意思的是,Chemerin在结构和进化上与抗菌肽蛋白cathelicidin具有较高同源性,体外实验显示Chemerin具有直接杀伤金葡菌的能力。然而,对Chemerin/CMKLR1轴在皮肤金葡菌感染中所起的作用及机制并不清楚。

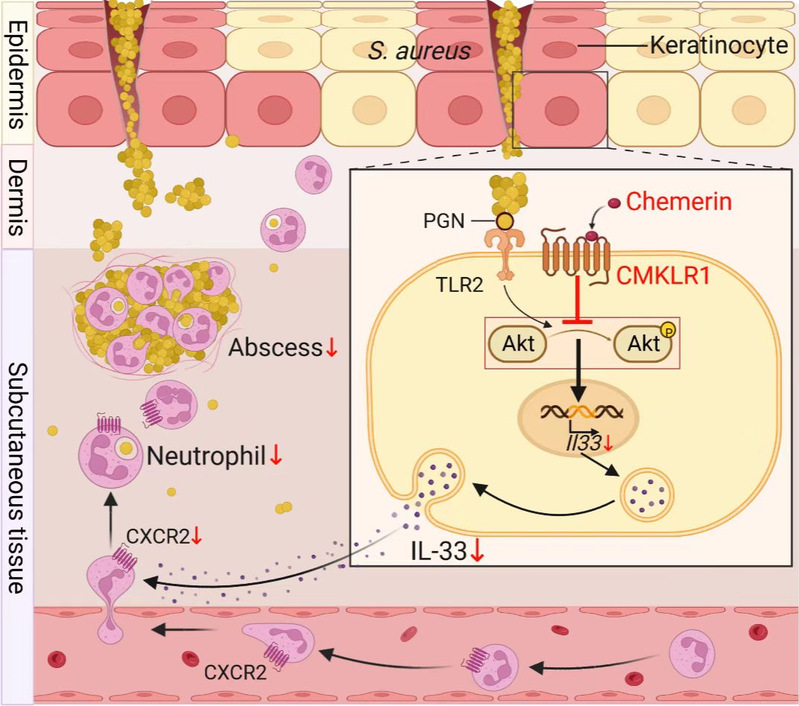
近日,上海市重大传染病和生物安全研究院兼聘PI,复旦大学基础医学院何睿课题组联合眼耳鼻喉医院李华斌课题组在Cellular & Molecular Immunology发表了题为The chemerin-CMKLR1 axis in keratinocytes impairs innate host defense against cutaneous Staphylococcus aureus infection的研究论文,显示Chemerin/CMKLR1轴通过抑制金葡菌感染的角质形成细胞(KC)上调表达IL-33,消弱抗金葡菌的中性粒细胞炎症,加重皮肤金葡菌感染和全身扩散,提示Chemerin/CMKLR1轴是介导金葡菌的固有免疫逃逸的一个重要宿主因素。
该研究利用小鼠金葡菌皮下感染模型发现,皮下脂肪是Chemerin的主要来源。敲除Chemerin或受体CMKLR1明显减轻金葡菌感染的小鼠皮肤的损伤面积以及皮肤、肾脏和脾脏载菌量,且该效应依赖于增强的感染皮肤中性粒细胞浸润。中性粒细胞并不表达CMKLR1,且缺失Chemerin/CMKLR1轴也不影响常见的中性粒细胞相关趋化因子的表达,相反却上调KC表达IL-33,全敲或KC条件敲除 IL-33证实了Chemerin/CMKLR1轴缺失引起的增强的抗金葡菌中性粒细胞应答完全依赖IL-33。机制上,IL-33通过上调中性粒细胞表达的CXCR2,增强其对趋化因子CXCL1/2的趋化应答。有意思的是,小鼠过表达Chemerin,在不引起肥胖的情况下,模拟肥胖个体的高Chemerin水平,能够下调金葡菌感染皮肤的IL-33水平,加重金葡菌局部和全身感染。
进一步,通过分别条件敲除KC、巨噬细胞和脂肪细胞的Cmklr1表达,确定了KC是Chemerin的作用靶点,并揭示了Chemerin/CMKLR1轴抑制金葡菌感染KC上调表达IL-33的分子机制:Chemerin/CMKLR1轴并不影响金葡菌分泌的毒素诱导KC表达IL-33,而是主要通过下调Akt磷酸化,抑制金葡菌主要的病原相关模式分子肽聚糖(PGN)诱导KC表达IL-33。
综上,我们的研究揭示了Chemerin/CMKLR1轴通过抑制金葡菌感染诱导KC表达警示素IL-33,消弱感染皮肤中性粒细胞的浸润,导致皮肤金葡菌的固有免疫逃逸,加重金葡菌感染。该研究也提示,虽然CMKLR1激动剂减轻非感染性组织病理性炎症的同时可能存在增加皮肤金葡菌感染的风险,也为肥胖人群对金葡菌感染更易感这一临床现象提供了机制上的解释。
复旦大学基础医学院陈郁博士、宋燕博士以及上海市重大传染病和生物安全研究院博士生王哲为本文的共同第一作者。该研究获得了复旦大学教育部/卫健委医学分子病毒学重点实验室重点项目和上海市科委面上项目的资助。
原文链接:https://www.nature.com/articles/s41423-024-01152-y

