2024年7月22日,上海市重大传染病和生物安全研究院王欣玲/姜世勃团队在Current Research in Microbial Sciences(IF:4.8)上发表了题为“Alpaca-derived nanobody targeting the hydrophobic pocket of the HIV-1 gp41 NHR broadly neutralizes HIV-1 by blocking six-helix bundle formation”的研究论文。

HIV-1感染宿主细胞的过程中,首先通过其表面糖蛋白gp120与受体CD4和辅助受体CCR5或CXCR4结合,诱导gp41的构象变化,使gp41的融合肽(fusion peptide,FP)释放并插入靶细胞膜中。此后,N端七肽重复序列(NHR)形成三聚体卷曲螺旋结构,导致其表面暴露一个保守的疏水口袋,随后,C端七肽重复序列(CHR)逆转并与NHR三聚体紧密结合,形成稳定的六螺旋束(six-helix bundle, 6-HB),最终导致靶细胞膜与病毒囊膜之间的膜融合。因此,跨膜糖蛋白gp41从前发夹(pre-hairpin)中间状态到后发夹(post-hairpin)融合状态的构象转变对于HIV-1与细胞融合过程是必不可少的。
在此过程中形成的gp41 NHR三聚体表面的疏水口袋区只在病毒与靶细胞融合时瞬间暴露,在天然状态下并不存在,故先前存在的抗体不易诱导其突变。因此,该区域是非常理想的抗体药物设计靶点。然而,由于该口袋区在瞬时暴露时所造成的空间位阻和动力学障碍,针对该口袋区的完整抗体IgG分子(~150KD)太大,很难进入该区发挥病毒中和作用。因此,如何获得特异性针对NHR三聚体表面的疏水口袋区,又能容易进入该区的抗体是抗HIV-1抗体药物研发领域存在的关键科学问题之一。
从骆驼科动物体内获得的纳米抗体(Nb)仅包含免疫球蛋白的重链可变区(VHH),分子量仅为常规IgG的10%(~15KD),更适于完整IgG无法进入的HIV-1包膜上的沟槽,其中就包括gp41 NHR三聚体表面的口袋区。此外,与人源VH抗体相比,VHH有较长的CDR1和CDR3区,并且较长的CDR3区会与相邻的CDR2或者CDR1区形成二硫键来稳定其结构,这个CDR3形成凸出的环状可能特异性识别隐藏的抗原表位。因此,本研究中,我们通过使用报道的可模拟gp41 NHR三聚体的蛋白(covNHR-VQ)作为抗原免疫羊驼,获得了一系列靶向HIV-1 gp41 NHR的羊驼源纳米抗体。
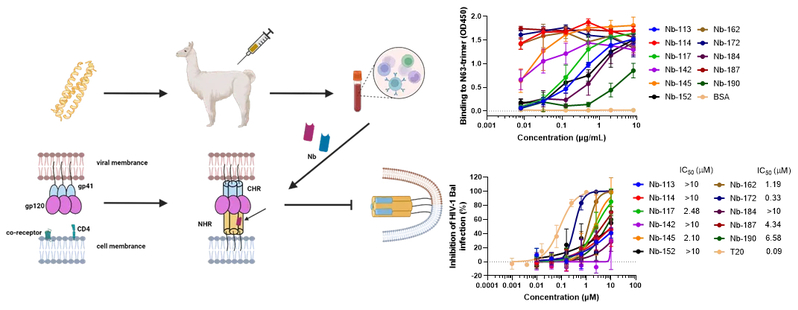
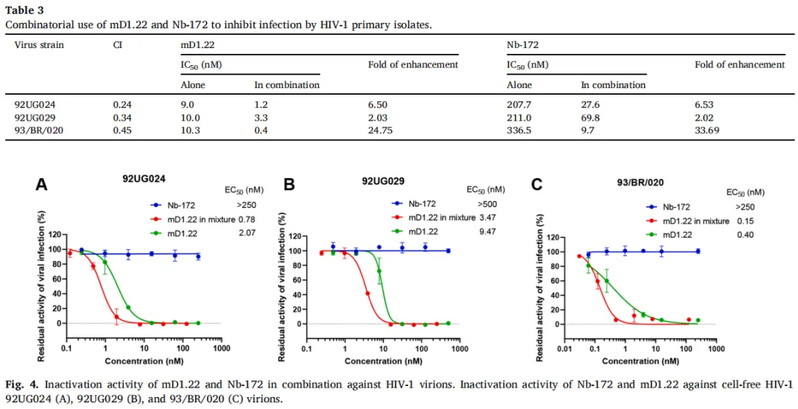
大多数纳米抗体与N63三聚体蛋白的结合呈浓度依赖性,其中一些纳米抗体,如Nb-162、Nb-172和Nb-187,对N63三聚体表现出更强的亲和力。然而只有Nb-162和Nb-172 对HIV-1实验室适应株Bal显示出较强的中和活性,IC50(半数抑制浓度)值分别为1.19和0.33 μM。同时,纳米抗体Nb-172对HIV-1假病毒、HIV-1临床分离株和T20耐药株表现出广谱的中和活性。而且,Nb-172与靶向gp120的CD4衍生物抑制剂—mD1.22联合使用时,在抑制HIV-1感染和灭活游离病毒颗粒方面表现出协同作用,对不同HIV-1临床分离株感染抑制效力分别增长2~25倍和2~34倍。联合指数(CI)分别为0.24、0.34和0.45,表明二者具有较强的协同效应。Nb-172本身没有,而mD1.22具有灭活游离病毒颗粒的能力,当Nb-172与mD1.22联用时,使得mD1.22对HIV-1的灭活活性被增强了1.7倍。
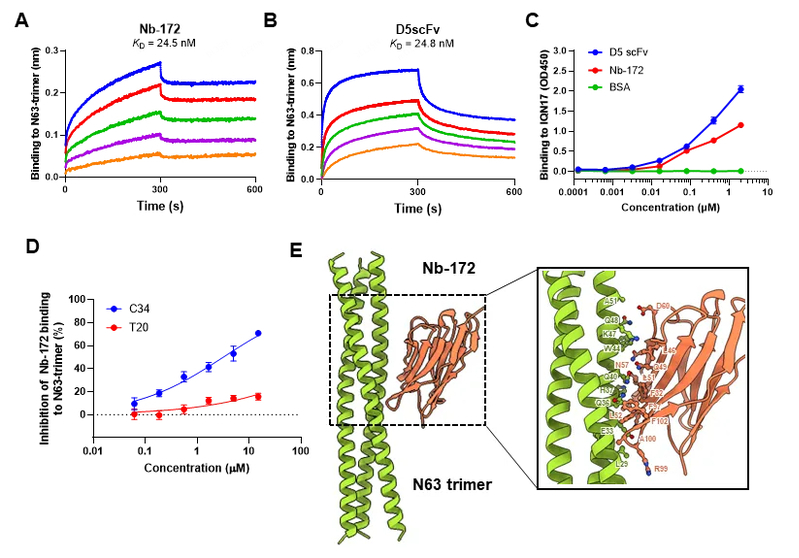
最后,我们证实了Nb-172可以竞争性结合gp41 NHR的疏水口袋,从而抑制6-HB的形成。BLI的结果显示Nb-172与N63-三聚体具有较强的结合能力,KD值为24.5 nM。在评估Nb-172和CHR衍生肽C34和T20竞争性结合HIV - 1 gp41 NHR的能力时,C34多肽以浓度依赖的方式阻断Nb-172与N63三聚体的结合,提示Nb-172与C34的结合表位可能存在重叠。N-PAGE证实Nb-172可以阻断N36与C34多肽形成6-HB。我们利用Alpha Fold3预测N63三聚体与Nb-172复合物的结构,显示Nb-172主要通过其CDR2和CDR3与N63的L29-A51残基(gp41 NHR 557~579)结合,而这一预测位点与ELISA的实验结果吻合。
综上所述,我们首次报道了靶向gp41 NHR疏水口袋区的驼源纳米抗体Nb-172,其具有广谱的抗HIV-1活性,且与mD1.22联用时对HIV-1的抑制和灭活具有显著的协同作用,值得进一步的开发。
本研究由王欣玲/姜世勃团队同成都阿帕克生物科技有限公司合作完成,公司负责纳米抗体筛选、表达及纯化工作。复旦大学孙禄加博士生和成都阿帕克生物科技有限公司陈波为本文的共同第一作者,上海市重大传染病和生物安全研究院姜世勃教授和王欣玲青年研究员为本文的共同通信作者。

