近期上海市重大传染病和生物安全研究院、复旦大学附属华山医院感染科、国家传染病医学中心的张继明团队和厦门大学公共卫生学院、国家传染病诊断试剂与疫苗工程技术研究中心夏宁邵教授/袁权教授团队共同合作揭示免疫逃逸对新冠奥密克戎的进化影响,相关成果于8月18日发表于Cell Discovery杂志(2023 IF: 33.5)。

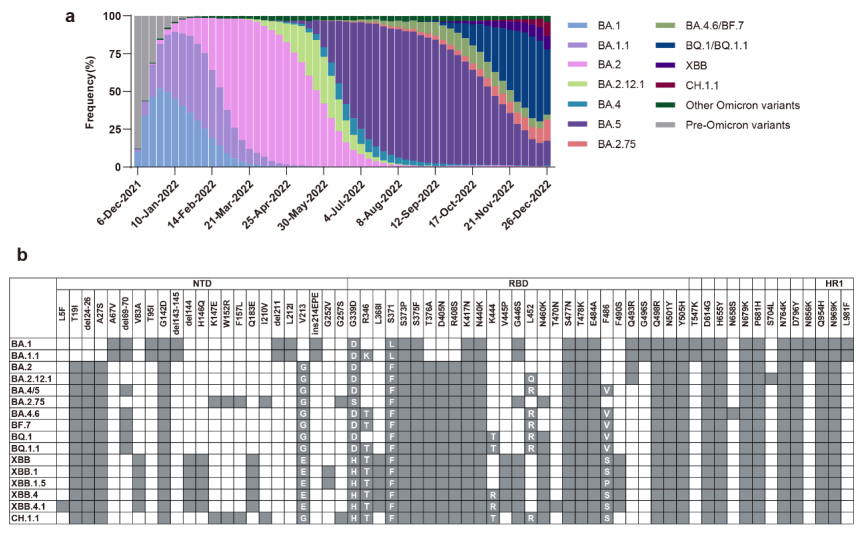
回顾Omicron变异株的进化轨迹,在以前的毒株上引入刺突突变是新毒株获得病毒传播适应性优势的有效办法。为了阐明BA.4/5期间氨基酸突变的免疫逃逸作用,研究者们在 BA.4/5 刺突主链上构建了34个具有单氨基酸RBD突变的变体(图1a)。3d-BA.4/5-HCP(三针疫苗接种后BA.4/5突破性感染个体)血清样本和 3d-BA.2-HCP (三针疫苗接种后BA.2突破性感染个体)血清样本用于这些变体的分析。
Omicron变异株的进化轨迹
研究结果显示:与BA.4/5相比,3d-BA.4/5-HCP对Y449N、K444R/N、V445P和G446V的nAb几何平均滴度(GMT)显着降低,3d-BA.2-HCP对D339H/Y、R346I/T、K444R/N、V445F/P、G446V/D、Y449N、N450K、N460S、A484V 和 F490S/K/L,nAb GMT显着降低(图1b)。对于BA.2或BA.4/5突破性感染引起的抗体,氨基酸444、445、446和449处的突变比其他位点具有更显着的中和逃逸能力(图1c)。
接下来,研究者们使用指数增长模型分析了2022年5月至12月收集的病毒序列中包含这些替换的病毒序列的动态频率。R2用于定量衡量突变增长的趋势。值得注意的是,BA.4/5后代中所有突变的R2与它们对3d-BA.4/5-HCP的逃逸能力呈正相关(r = −0.5193,P = 0.0033),3d-BA.2-HCP(r = −0.4988,P = 0.0050)(图1d)。相比之下,在同一时期的BA.2及其后代中,nAb滴度和R2之间没有观察到显着相关性(图1e)。对于3d-BA.4/5-HCP和 3d-BA.2-HCP,氨基酸444、445和446处的突变导致更明显的 nAb衰减(图1f)。这些发现揭示了突变相关的中和逃逸效应与其在人群中的频率增长之间的统计关联,表明具有增强免疫逃逸的新变体更适合传播。
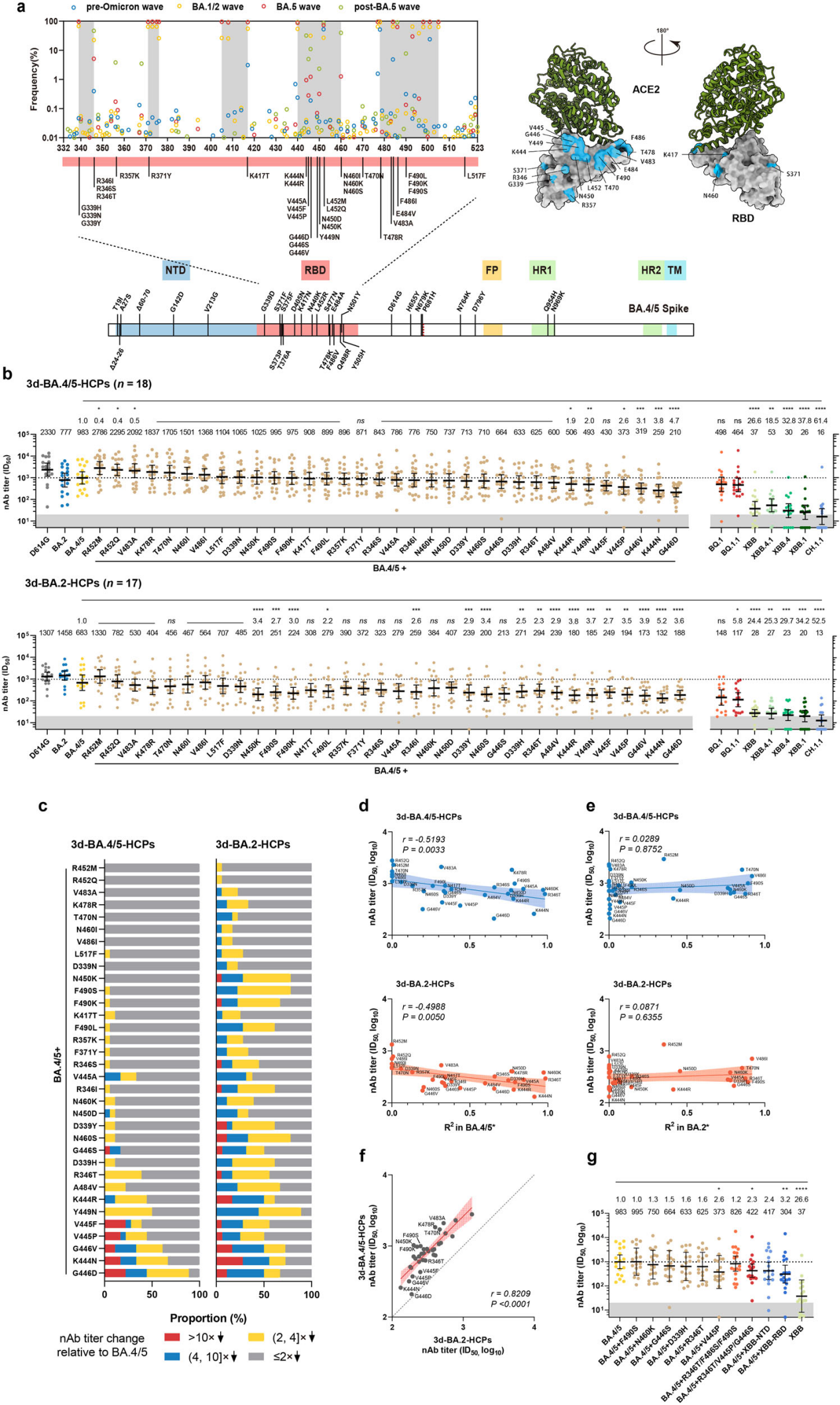
图1
对于新冠病毒,2020年至2021年传播的早期 VOC/VOI 变体(例如 Alpha、Beta和Delta)似乎具有增强的传播性和扩展的跨物种趋向性。然而,在群体免疫的情况下,抗原逃逸可能是对病毒传播适应性最有利的影响。
根据这些结果,可以预测当前疫苗和/或自然感染所赋予的初始免疫力可能无法抵御下一波突变病毒的挑战。未来针对感染XBB等毒株的个体的逃逸突变可能是下一轮病毒进化的主要方向。
上海市重大传染病和生物安全研究院、复旦大学附属华山医院感染科张继明教授,复旦大学附属华山医院感染科毛日成副主任医师,华山医院检验医学科关明教授,厦门大学公共卫生学院夏宁邵教授、袁权教授、张雅丽助理教授为共同通讯作者。复旦大学附属华山医院博士研究生陈诗琦、郭悦,厦门大学公共卫生学院博士研究生黄泽宏、郭慧琳,厦门大学附属第一医院简丽娟主治医师为共同第一作者。
文献链接:https://www.nature.com/articles/s41421-023-00584-6

