2025年12月15日,上海市重大传染病和生物安全研究院/复旦大学基础医学院张荣团队等合作在Nature Communications发表题为“Development of a replication-defective mpox virus platform for fundamental and therapeutic research”重要研究成果。该研究成功构建了基于细菌人工染色体(BAC)的复制缺陷型猴痘病毒(replication-defective MPXV, rdMPXV)平台。该平台通过双基因(OPG96/OPG158)缺失策略获得了单轮感染的复制缺陷型病毒颗粒,完整保留了病毒的生命周期关键环节。研究者以此为工具, 完成了概念验证性高通量药物筛选,发现了新型抗痘病毒先导化合物G243-1720,并意外发现该化合物与已获批药物特考韦瑞(tecovirimat)虽结构迥异,却共享同一靶点(OPG57/F13),通过诱导靶蛋白二聚化发挥抑制作用。本研究不仅为猴痘病毒的基础研究提供了安全、灵活且强大的遗传学操作平台,也为抗痘病毒药物和疫苗研发开辟了新路径。
研究背景与挑战:猴痘病毒研究的“高墙”
猴痘病毒 (MPXV) 隶属痘病毒科正痘病毒属,该病毒与天花病毒、痘苗病毒及牛痘病毒等重要病原体存在密切亲缘关系。2022年MPXV Clade IIb在世界范围内的流行以及2024年的MPXV Ib分支病例的大量增加致使世界卫生组织两次将其列为国际关注的突发公共卫生事件 (PHEIC),揭示了MPXV持续演变的公共卫生威胁。目前临床可用的抗MPXV药物寥寥(仅tecovirimat和cidofovir/brincidofovir),且存在疗效不确定性或毒副作用等问题。然而,猴痘病毒近200kb庞大且复杂的病毒基因组以及对其操作所需的高生物安全级别限制了科学家对其复制机制、宿主互作、疫苗开发和抗病毒化合物筛选的研究。传统的基于同源重组和筛选标记的基因编辑方法对MPXV效率低下、流程繁琐。因此,开发一种能在较低生物安全条件下模拟活病毒关键生命周期的研究平台,具有重要的科学与应用价值。
技术创新:构建稳定、安全的rdMPXV平台
1. 从“头”组装策略
研究团队摒弃了从感染性病毒出发的传统改造路径,采用了从头合成(de novo)策略。利用酵母转化相关重组(TAR)克隆技术,将MPXV Clade IIb基因组(~197 kb)分为23个片段进行逐步组装,构建了含有病毒囊膜组装关键蛋白基因 OPG96 (M2R) 缺失的中间质粒pBAC-IΔ96,并进一步组装了猴痘病毒全基因组的BAC质粒pBAC-MPXVΔ96。随后在互补表达OPG96的细胞上,成功包装出复制缺陷型猴痘病毒颗粒(rdMPXVΔ96)。
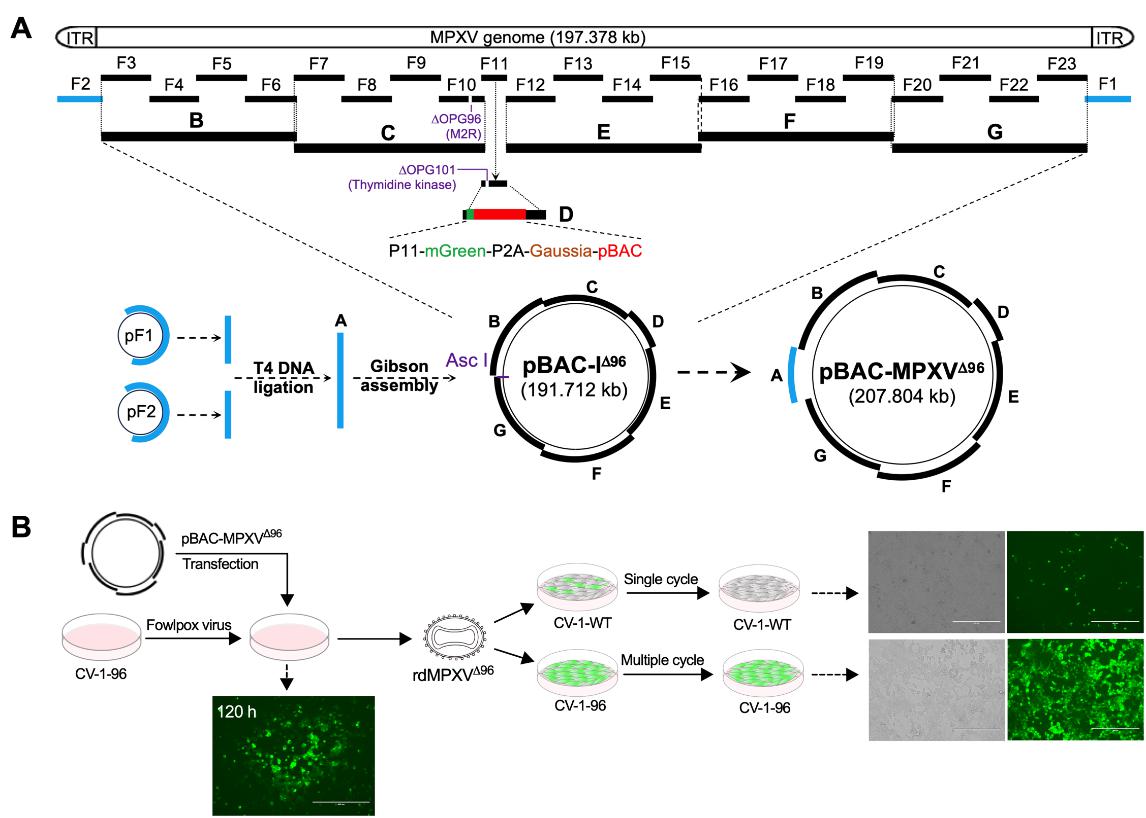
2. 双重基因缺失
为进一步提升安全性,研究团队在pBAC-IΔ96基础上,创新性地结合CRISPR-Cas9与Lambda Red重组系统,在E. coli中敲除了第二个病毒囊膜组装关键蛋白基因 OPG158 (A32.5L),获得双基因同时缺失的质粒pBAC-IΔ96,158。随后在互补表达OPG96和OPG158的细胞上,成功包装出双缺型复制缺陷型猴痘病毒颗粒(rdMPXVΔ96,158)。
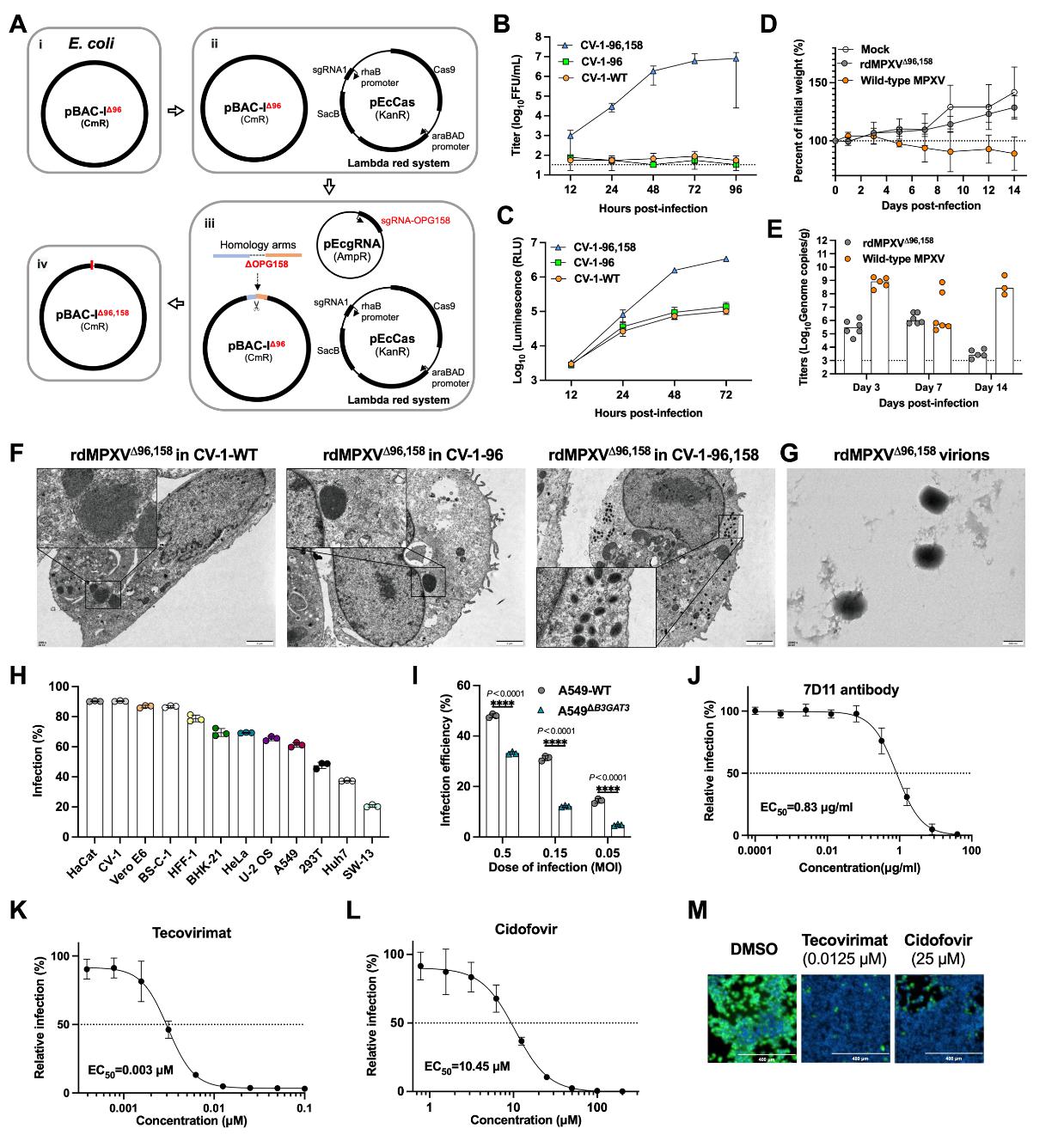
3. 平台特性验证:安全性与保真度
严格的复制缺陷性:rdMPXVΔ96,158只能在互补细胞系中完成多轮复制,在野生型细胞中仅发生单轮感染,不能产生子代病毒颗粒。在睡鼠(dormice)模型中,该病毒不引起体重下降或肺部有效复制,证明了其体内安全性。
生命周期模拟能力:在互补细胞中电镜可观察到完整的胞内成熟病毒(IMV)和胞外包膜病毒(EEV)形态;病毒表现出与野生型病毒相似的细胞嗜性。
平台稳定性: 通过连续传代后,病毒基因组在缺失区域和报告基因区域均未出现突变。
药效评价可靠性: 使用该平台测定的中和抗体(7D11)以及特考韦瑞和西多福韦的EC50值,与文献中使用野生型病毒报道的结果高度一致,验证了平台用于药效评估的可靠性。
平台应用:发现新型先导化合物G243-1720
1. 先导化合物的发现与特征
作为概念验证,研究者利用rdMPXVΔ96,158平台对包含3185个小分子的化合物库进行了高通量筛选。筛选鉴定出化合物G243-1720,其抗MPXV活性EC50约0.23 μM,CC50 > 100 μM,选择指数(SI)优异。该化合物对多种正痘病毒(VACV、CPXV、CMLV、RPXV)均表现出广谱抑制活性,但对禽痘病毒、疱疹病毒及RNA病毒无效,体现了其作用靶点的保守性与特异性。在SCID小鼠的MPXV感染模型中,腹腔注射(22.5 mg/kg)或口服(45 mg/kg)G243-1720,可显著降低肺部组织病毒载量。
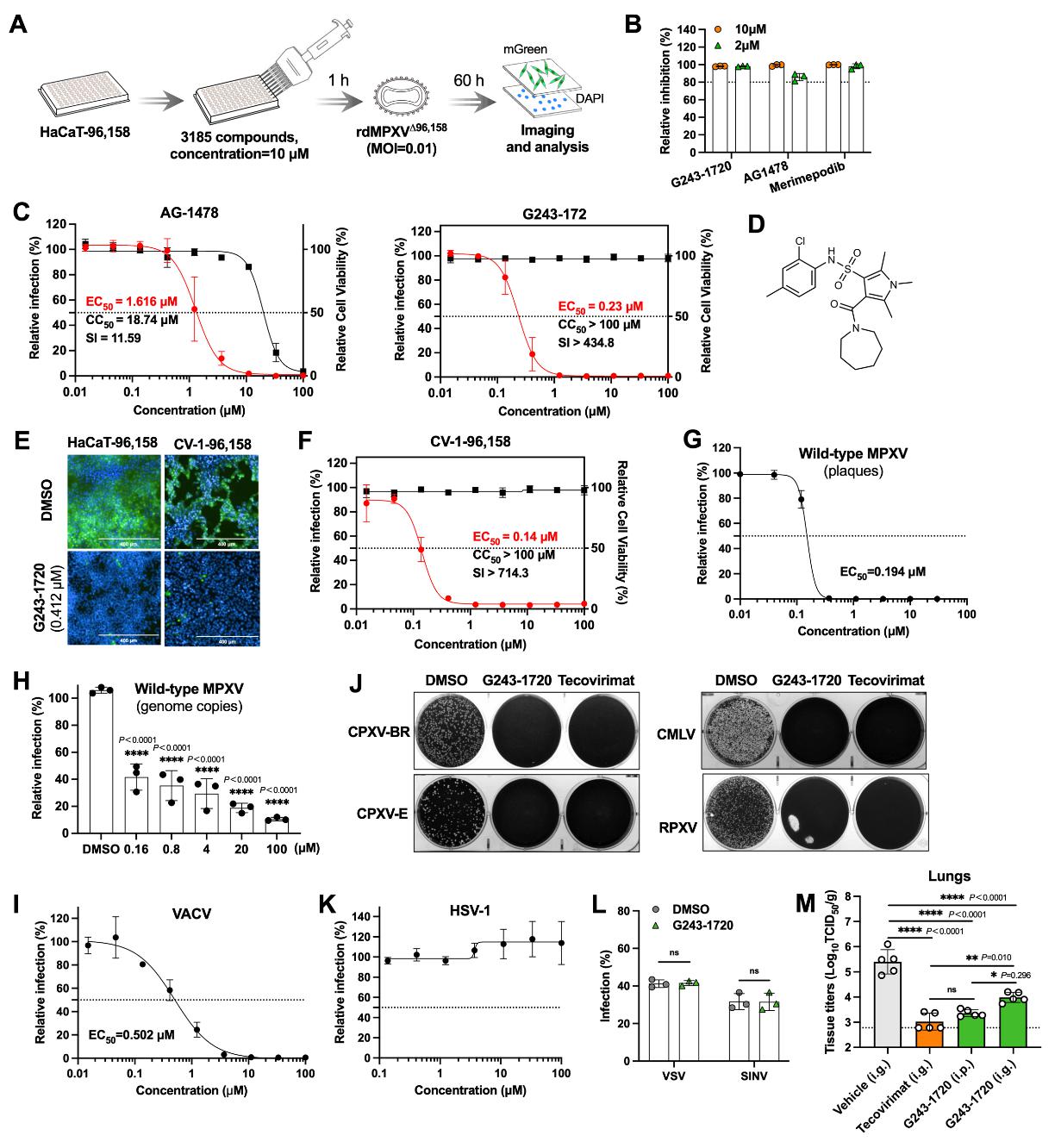
2. 机制深度解析:与特考韦瑞殊途同归
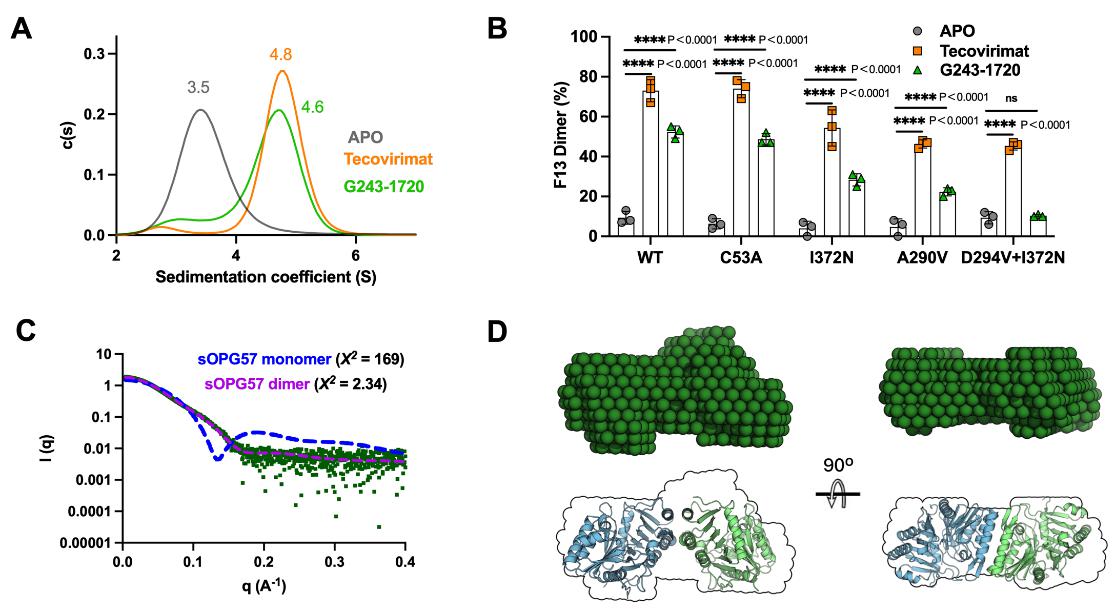
通过系统分析病毒复制周期关键节点,发现G243-1720与特考韦瑞类似,不影响病毒入侵细胞、基因组DNA复制、晚期基因表达和IMV的形成,但能显著抑制EEV的产生和病毒噬斑扩散。 在G243-1720压力下进行病毒传代,筛选出位于 OPG57 (F13L) 基因的耐药突变(A290V、D294V、I372N)。这些位点正是已知的特考韦瑞和另一个F13抑制剂IMCBH的经典耐药位点。携带I372N突变的病毒对G243-1720和特考韦瑞均表现出交叉耐药,提示二者靶向同一蛋白。
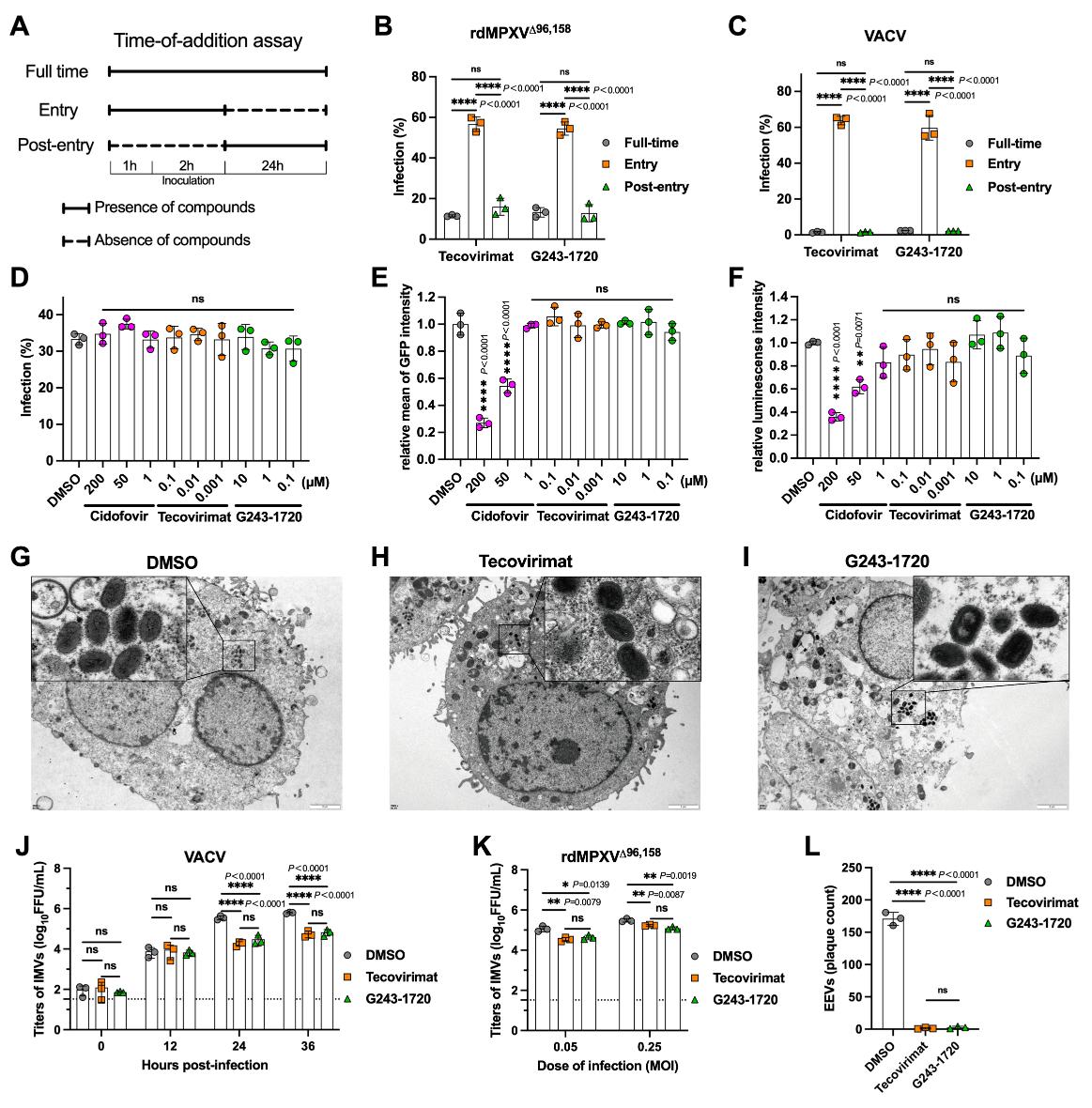
分析超速离心(AUC)和质谱光度法(mass photometry)证实,G243-1720与tecovirimat一样,能诱导可溶性OPG57蛋白形成同源二聚体。耐药突变显著削弱了这种诱导能力。尽管晶体学数据分辨率有限,但在OPG57蛋白二聚体界面观察到了与G243-1720分子形状匹配的电子密度,进一步支持其结合于tecovirimat相同的口袋。
总结和展望
1.创建了一个创新性的复制缺陷性猴痘病毒研究平台
安全性高: 双基因缺失设计,单轮感染特性,将实验操作的安全性要求降低。
功能完整: 模拟病毒生命周期,适用于病毒进入、复制等多环节研究。
灵活高效: 基于BAC和CRISPR/Lambda Red系统,允许对庞大基因组进行快速、多重的遗传操作。
转化性强: 已成功用于高通量药物筛选、中和抗体评价、宿主因子鉴定等。
2. 发现了一个新型先导化合物G243-1720
作为第三个被报道的OPG57(F13)蛋白抑制剂,具有全新的化学骨架,与特考韦瑞“殊途同归”的作用机制,不仅验证了OPG57作为抗痘病毒药物的有效靶点,也为开发具有不同药学特性的备份药物或联合用药方案奠定了基础。
总之,复制缺陷型猴痘病毒平台可用于更广泛的宿主-病毒互作研究、疫苗评估及大规模药物筛选,以及作为载体开发新型疫苗等。G243-1720作为先导化合物则还需进行系统的开发,包括结构优化、安全性评价以及在不同动物模型中的疗效验证等,以期为应对猴痘及其他正痘病毒威胁提供新的候选药物。
来自上海市重大传染病和生物安全研究院/复旦大学基础医学院张荣研究员、谢幼华教授等为本文通讯作者;博士后陈建南和博士生胡力元等为第一作者。该研究同时得到了来自中山大学、法国巴斯德所、中国农科院、吉林大学、中科院药物所、中国医科院等单位研究人员的支持,也得到了上海市市级科技重大专项“重大突发传染病防控关键核心技术研究”、上海市优秀学术带头人项目等的资助。
原文链接:https://www.nature.com/articles/s41467-025-67487-w

