近年来,上海市重大传染病和生物安全研究院持续发力,全面推进重大新发突发传染病防控关键核心技术的市级科技重大专项,筑牢生物安全科技防线,取得了一系列突破性进展,为保障超大城市的公共卫生安全提供有力支撑。
急性肺损伤新靶点:PARK7通过整合脂代谢与组蛋白乳酸化纠正内皮铁死亡与功能障碍
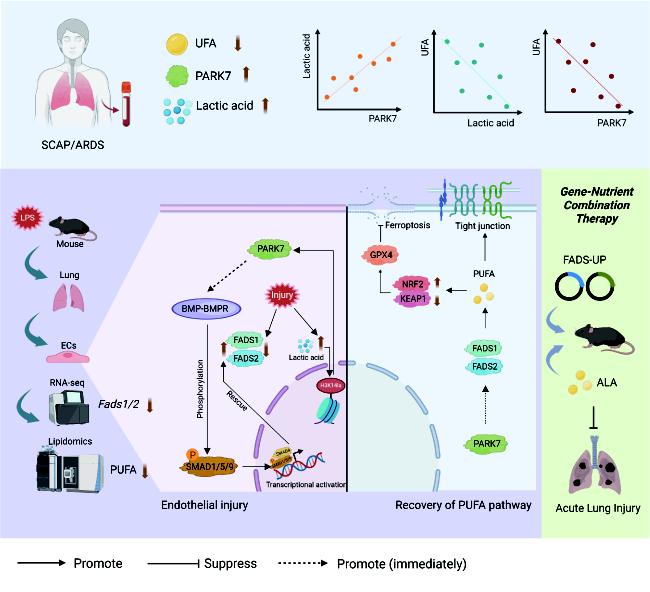
急性呼吸窘迫综合征(ARDS)及其前期阶段急性肺损伤(ALI)是重症患者死亡的重要原因之一,目前仍缺乏有效药物治疗手段。肺血管内皮细胞作为肺泡屏障的关键组成部分,其功能障碍是ALI/ARDS发生发展的核心环节。然而,损伤过程中内皮细胞的代谢变化及其调控机制尚不明确。
近日,上海市重大传染病和生物安全研究院/复旦大学附属中山医院呼吸与危重症医学科宋元林教授团队通过多组学手段,发现了急性肺损伤中关键的脂质代谢变化和关键的调控靶点,首次揭示了PARK7蛋白通过整合多不饱和脂肪酸(PUFA)代谢与组蛋白乳酸化修饰,形成保护性反馈回路,显著抑制内皮细胞铁死亡和屏障损伤。该研究不仅进一步揭示了了ALI中内皮细胞的代谢重编程事件的多样性,而且也为ARDS/ALI的临床防治提供了新的潜在靶点。团队该工作在《Advanced Science》杂志上发表。
基础研究突破:以PARK7为中心的脂肪酸代谢-乳酸化调控环路
发现代谢—表观交叉对话新轴心:研究人员通过转录组与脂质组学分析,首次发现ALI中肺内皮细胞的Omega-3多不饱和脂肪酸合成通路显著下调,尤其是关键限速酶FADS1/2表达降低。进一步实验证实,FADS1/2的激活或Omega-3脂肪酸补充可有效抑制内皮细胞铁死亡,恢复屏障功能。
揭示PARK7的双重调控机制:基于前期研究发现的PARK7内皮保护作用,研究首次报道抗氧化蛋白PARK7是FADS1/2的内源性调控因子,通过激活BMP-BMPR-SMAD1/5/9信号通路,直接促进FADS1/2转录,进而恢复PUFA代谢,抵抗铁死亡。
发现乳酸化驱动的反馈环路:在ALI状态下,内皮细胞组蛋白H3K14乳酸化水平显著上升,直接结合于PARK7基因启动子区,驱动其转录上调。而PARK7的上调又反过来恢复FADS1/2表达,形成一个自我强化的保护性反馈回路,对抗代谢紊乱和细胞死亡。
治疗应用创新:基因调控和脂肪酸补充互补
不饱和脂肪酸含量的临床意义:临床样本和动物实验提示重症肺炎中血浆不饱和脂肪酸减少的普遍性,尤其是Omega-3脂肪酸的降低;不饱和脂肪酸含量与临床严重程度相关。
基因调控和补充治疗的一致性:恢复损伤的内皮细胞的FADS1/2表达或者外源给予Omega-3脂肪酸缓解了内皮细胞铁死亡和链接功能异常。
内皮细胞和肺上皮性肿瘤细胞的反应差异:恢复生理状态的Omega-3脂肪酸可促进损伤的内皮细胞存活,而相同浓度的Omega-3脂肪酸可加重肿瘤细胞损伤。相较于肿瘤细胞,正常细胞对Omega-3脂肪酸表现出更好的耐受性。。
提出联合治疗新策略: 在动物模型中,肺内皮特异性过表达Fads1/2 或 全肺过表达联合Omega-3脂肪酸(α-亚麻酸)补充,均能显著减轻LPS诱导的肺损伤,改善炎症反应与氧化应激。联合Omega-3脂肪酸治疗同时可以“压制”FADS1/2表达恢复带来的花生四烯酸产物的上调,为“基因调控+饮食补充治疗ALI”模式的临床转化提供了实验依据。
图示:PARK7通过整合脂代谢与组蛋白乳酸化纠正内皮铁死亡与功能障碍核心发现与机制假说
应用前景和意义
上海市重大传染病和生物安全研究院/复旦大学附属中山医院呼吸与危重症医学科宋元林教授团队长期致力于感染性ARDS/ALI的发病机制和治疗研究,重点关注呼吸屏障的稳态、损伤和修复机制等,研究涉及上皮细胞、内皮细胞、巨噬细胞等参与ALI发病的具体机制,肺内源性干细胞在损伤中的调控与修复作用以及相关药物的研发和临床应用。
该研究首次将内皮细胞的PUFA代谢、组蛋白乳酸化与铁死亡三大病理过程串联起来,构建了一个由PARK7为核心的“代谢—表观”调控网络。这不仅深化了对ALI/ARDS发病机制的理解,也为开发靶向代谢重组或表观修饰的联合治疗策略奠定了理论基础。未来,基于该通路的药物研发,如FADS1/2激动剂、PARK7激动剂,以及药物联合脂肪酸补充有望为ARDS/ALI治疗带来新的希望。
*若对本成果感兴趣并有合作意向,敬请联系我院科研办(联系电话:021-54231675)进行进一步的沟通与探讨。
*本成果由上海市市级科技重大专项“重大突发传染病防控关键核心技术研究”经费资助。

